近期干細胞研究進展匯總!
1.Science:激活溶酶體可讓衰老的神經干細胞恢復青春
在一項新的研究中,來自美國斯坦福大學醫學院的研究人員發現在小鼠大腦中,年輕的靜止性神經干細胞(resting neural stem cell)在它們的溶酶體(細胞中的一種特定的細胞器,用于處理細胞垃圾)中儲存著大量的蛋白聚集物。相 關研究結果發表在2018年3月16日的Science期刊上,論文標題為“Lysosome activation clears aggregates and enhances quiescent neural stem cell activation during aging”。論文通信作者為斯坦福大學老化生物學中心副主任Anne Brunet,論文第一作者為博 士后研究員Dena Leeman博士。 這些研究人員先是觀察靜止性神經干細胞的基因表達譜與那些對觸發新的神經元產生的外部信號作出反應的活化神經干細胞(activated neural stem cell)的基因表達譜之間可能存在的差異。他們比較了當它們衰老時,它們如何作出改變。
Leeman從來自年輕小鼠和老年小鼠的大腦中分離出幾種細胞群體進行研究,包括靜止性神經干細胞、活化神經干細胞和由活化神經干細胞產生的神經祖細胞。她發現靜止性神經干細胞表達許多與溶酶體相關的基因,而活化神經干細胞表達與一種參與蛋白破壞的蛋白復合 物(被稱作蛋白酶體)相關的基因。嚴格控制蛋白產生和清除可讓細胞維持必需的蛋白庫存來以執行所需的細胞功能。
當Leeman利用一種結合到蛋白聚集物上的染料對年輕的靜止性神經干細胞和活化神經干細胞進行染色時,她吃驚地發現靜止性神經干細胞經染色后變得更加明亮,不過它們具有較低的蛋白產生率。Leeman還發現,相比于活化神經干細胞,年輕的靜止性神經干細胞在它們 的溶酶體中相對較慢地堆積這些蛋白聚集物。
2.JCI:上海交大醫學院發現清除白血病干細胞的潛在新靶點
白血病干細胞是與白血病發生、發展和復發有關的一群細胞,在白血病干細胞上發現新的治療靶點對于徹底治愈白血病有至關重要的意義。最近來自上海交通大學醫學院的鄭俊克和陳國強院士等人在白血病干細胞上發現了一個高表達的基因,并揭示了該基因參與白血病發生的重要機制。相關研究結果發表在國際學術期刊JCI上。
在這篇報道中,研究人員發現JAM3(junctional adhesion molecular 3)在小鼠和人的白血病干細胞中高水平表達,在MLL-AF9誘導的小鼠急性髓系白血病模型的系列移植過程中清除Jam3能夠幾乎完全阻止白血病的發生過程。相比之下,jam3缺失并不會影響小鼠造血干細胞的功能。
除此之外,研究人員還發現敲低JAM3會導致人白血病細胞系和原代白血病干細胞的增殖受到抑制。機制研究表明JAM3能夠直接與LRP5發生相互作用激活下游的PDK1/AKT信號途徑,隨后GSK3β發生下調,β-catenin/CCND1信號途徑發生激活,以維持白血病干細胞的自我更新能力和進入細胞周期的能力。
3.Science:揭示動物組織再生藍圖
在一項新的研究中,來自美國懷特海德研究所的研究人員描述了一種關于真渦蟲(planarian)眼睛再生的模型:真渦蟲的眼睛再生受到同時發揮作用的三個原則的調控,這有助了解真渦蟲的祖細胞如何在再生中發揮功能。這種模型涉及位置線索;吸引祖細胞到現存結構的自組織(self-organization);起源自分散的空間區域而不是起源自精確位置的祖細胞,從而給它們的遷移路徑提供靈活性。這三個原則似乎確定著祖細胞在再生期間如何決定遷移到何處進行形態和功能重建,并且它們讓我們從系統水平上理解這個過程更接近一步。相關研究結果于2018年3月15日在線發表在Science期刊上,論文標題為“Self-organization and progenitor targeting generate stable patterns in planarian regeneration”。論文通信作者為懷特海德研究所研究院、麻省理工學院生物學教授和霍華德休斯醫學研究所研究員Peter Reddien博士。
Reddien和他的實驗室花了十多年的時間利用一種被稱作真渦蟲的小扁蟲來揭示再生之謎。如果一個真渦蟲的頭部被截斷,或者它的一側被切除,那么它的每一部分(比如它的被截斷的頭部和剩余的部分)都會再生出整個動物。為了理解祖細胞在動物再生的嘈雜環境中如何決定遷移到哪里,這些研究人員使用了真渦蟲的眼睛,它是一個肉眼看得見的器官,該器官足夠小以至于可在不會產生嚴重損傷的情況下將它切除,此外,它還含有人們已確定的祖細胞分子標志物。
這些研究人員設計了一個簡單的實驗來解決這些祖細胞如何決定遷移到哪里的問題:截斷真渦蟲的頭部,接著在三天后從這個被截斷的頭部部分移除一只眼睛。他們發現祖細胞會在位于剩余的一只眼睛的前面開始形成一只新的眼睛,而不是在解剖結構確定的“正確”位置(與剩余的這只眼睛相對稱的位置)上形成一只新的眼睛。但是,如果在更早的時候---與頭部截斷的同一天而不是在三天后---從被截斷的頭部部分移除一只眼睛,然后開展相同的實驗,那么會產生不同的結果:新的眼睛在與剩下的一只眼睛相對稱的位置---也就是身體結構的“正確”位置---上開始形成,這提示著當多種選擇存在沖突時,解剖結構的自組裝動力學取勝。
這些簡單的規則指導這種動物成功再生,并且當它的再生潛能被最大限度地挖掘時會產生替代性的穩定的解剖結構形態:產生具有三只眼睛、四只眼睛或五只眼睛的真渦蟲。切除這種動物的一側并且截斷它的頭部能夠讓它的祖細胞足夠遠地遠離現有的眼睛,從而允許在頭部部分中開始形成第三只眼睛。
4.Nat Biotechnol:干細胞療法治療黃斑退化
2015年6月, 86歲的Douglas Waters出現了嚴重的老年性黃斑變性癥狀(AMD),導致難以看清東西。幾個月之后,他成為了UC Santa Barbara的研究者開發的利用干細胞誘導分化的視覺細胞治療AMD的臨床試驗的一員。在手術之前,Douglas的視力很差,右眼幾乎看不到任何東西。而手術之后,他的視力恢復地很快,能夠閱讀報紙以及干一些農活。這項出色的臨床治療結果發表在最近一期的《Nature Biotechnology》雜志上,該文章描述了將從干細胞誘導而來的,工程化的視網膜色素上皮細胞移植進入患者的眼睛中,從而幫助AMD患者重建光明。結果表明該方法具有安全性以及有效性。
黃斑變性是發達國家中造成50歲以上人群視力損傷的主要原因。該疾病的發生主要是由于血管病變導致血液難以進入視網膜的中心黃斑區域。在這項研究中,作者希望能夠使用干細胞將患者眼部后側受損的細胞置換,從而恢復患者的視力。該手術總共耗時大概1到2小時。除了Douglas之外,該試驗中還有一名60歲的女性患者。在手術后的12個月內,她與Douglas兩人的視力恢復水平都十分顯著。此前他們都幾乎無法閱讀,而手術之后則能夠在佩戴正常眼鏡的情況下每分鐘閱讀60-80個字。
5.干細胞療法能夠修復更年期的過早出現以及生育問題
新聞來源:Stem cell therapy may help reverse effects of premature menopause, restore fertility
最近一項臨床研究指出,通過自體骨髓移植的手段能夠使因卵巢功能早衰而生育力下降的女性重新恢復生育能力,而且避免過早地進入更年期。相關結果在最近于芝加哥召開的第100屆內分泌學會年度會議上得到了展示。
"在接受治療的兩名受體中,我們發現其血清雌激素水平在接受干細胞移植后的三個月后出現了明顯升高,而且該效應能夠持續一年之久。患者的更年期癥狀得到了緩解。干細胞移植六個月后其經期得到了重新恢復"。該研究的高級作者,來自伊利諾伊斯大學的教授Ayman Al-Hendy說道。
研究者們計劃招募33名參與者進行臨床試驗,在目前已經接受治療的兩名患者中,他們從每名患者的髂嵴處提取了間葉干細胞并且通過微創腹腔鏡的手段將細胞注入自身一側卵巢中,同時保證另外一側卵巢不受影響。之后,研究者們定期對患者的血常規、卵巢成像以及更年期癥狀進行調查。
由于研究者們發現接受治療的女性其雌激素水平有明顯上升,而且開始出現經期反應。因此,研究者們希望能夠進一步恢復患者的生育能力。
6.Nat Med:首次證實人神經干細胞移植可改善脊髓損傷猴子的抓力
在一項新的研究中,研究人員報道移植到猴子受損脊髓中的人神經干細胞成熟為神經元,觸發神經連接形成,從而讓這些猴子抓住橙子的能力得到改善。相關研究結果近期發表在Nature Medicine期刊上,論文標題為“Restorative effects of human neural stem cell grafts on the primate spinal cord”。
在這項研究中,Tuszynski和他的同事們切掉獼猴的一段脊髓,然后在兩周后將人神經祖細胞(neural progenitor cell)移植到這種脊髓損傷部位。在首批4只猴子中,這些細胞移植物沒有保持在原位,這一發現迫使這些研究人員將更多的纖維蛋白原-凝血酶(fibrinogen–thrombin)添加到這些細胞移植物中。纖維蛋白原-凝血酶是一種蛋白-酶混合物,可讓這些移植物更快地附著到損傷位點上。Tuszynski團隊還不得不讓手術臺傾斜以便排出腦脊液,這是因為腦脊液會將這些移植物沖走。
經過這些調整后,在剩余的5只猴子中,這些移植的神經干細胞保留在原位,而且這些研究人員觀察到這些移植的干細胞發育成神經元和神經膠質細胞。在損傷部位中,這些人神經元產生高達15萬個線狀軸突,這些軸突從移植位點處向外延伸高達50毫米,并且早在這些新產生的神經細胞就位兩個月后,這些研究人員就能夠觀察到它們與猴子本身的神經細胞建立神經連接。在大多數情況下,細胞移植物附著在脊髓損傷部位的猴子能夠更好地操縱它們的手指,使它們的手指繞著橙子彎曲,而細胞移植物未附著的猴子并不能握住橙子,它們的手指保持折疊,因此橙子停留在它們的指關節上。
7.Nature:揭示SMAD2/3協調人多能性干細胞發育
為了讓細胞和組織正常地發揮功能,某些基因需要在正確的時間開啟和關閉,以響應來自細胞外的生長因子信號。已知SMAD2和SMAD3(SMAD2/3)蛋白是這個細胞信號轉導過程的一個重要的組成部分,在細胞內部被激活,開啟和關閉許多不同過程(從胚胎發育和生長到激活免疫系統或癌癥)所需的基因。
在一項新的研究中,來自英國劍橋大學的研究人員研究了人多能性干細胞---能夠產生人體所有組織和器官的細胞---中的SMAD2/3與其他蛋白之間的相互作用。他們發現盡管SMAD2/3確實結合一些轉錄因子,但是它們也與參與細胞中的一系列分子過程的蛋白發生相互作用,從而協調這些蛋白進行細胞信號轉導。相關研究結果發表在2018年3月8日的Nature期刊上,論文標題為“The SMAD2/3 interactome reveals that TGFβ controls m6A mRNA methylation in pluripotency”。
這些研究人員首次觀察到SMAD2/3能夠激活經過RNA編輯的蛋白,從而使得特定的mRNA變得不穩定和快速地降解。SMAD2/3發揮的作用是將細胞信號轉導與RNA編輯相關聯在一起,從而允許細胞開啟和隨后再次關閉對發育至關重要的基因。鑒于SMAD2/3的活性受到生長因子的調節,這項研究闡明了胞外信號能夠控制細胞功能的一種新方式。
8.Nat Protocol:科學家們培育出人類心臟3D模型

心臟是胚胎期第一個發育的器官,同時也是引發家長們顧慮的第一個器官。對于準媽媽們來說,懷孕的喜悅往往會被接受醫生檢查的不安感所掩蓋。家長們與醫生們往往要考慮母親的健康以及接受藥物治療后會對胎兒可能產生的影響。美國FDA要求所有藥物必須注明對孕婦以及嬰兒可能產生的威脅。一些藥物標簽上注明了其在動物水平的檢測中沒有發現致病風險,但還沒有在孕婦群體中進行仔細的研究。
Ma等人一直致力于研究人源誘導多能性干細胞(ips)技術在組織再生以及干細胞工程方面的應用。“這類干細胞能夠分化形成機體的任何類型的細胞”。多能性干細胞能夠再生形成心臟組織,但Ma等人相信他們能夠走得更進一步。
作者等人基于生物材料以及干細胞技術,建立了心臟的3D組織模型,該模型能夠模擬人類心臟的早期發育階段。通過在組織培養皿中加入一層多聚物,以及在其表面蝕刻形成微小的痕跡。范細胞能夠與上述痕跡牢固地結合。由于干細胞本身并不會粘附在多聚物上,因此他們能夠沿著蝕刻痕跡生長,并最終發育形成3D結構。作者等人的研究重點在于心臟組織,但其它實驗室也可以利用上述技術建立其它組織以及器官。相關結果發表在最近一期的《Nature Protocol》雜志上。
9.Sci Transl Med:重磅!利用牙齦中的間充質干細胞來加速傷口愈合!
我們常常會注意到口腔內的傷口愈合速度會比其它部位的傷口愈合速度要快,牙齦組織的修復速度大約是皮膚損傷修復速度的兩倍,而且其還能減少疤痕的形成,其中一個原因或許就是牙齦間充質干細胞(gingival mesenchymal stem cells,GMSCs),其能夠產生多種類型的細胞;近日,一項刊登于國際雜志Science Translational Medicine上的研究報告中,來自賓夕法尼亞大學的科學家就通過研究闡明了牙齦間充質干細胞加速組織修復的新型分子機制。
早期研究中,研究人員發現,間充質干細胞能夠通過在胞外囊泡中釋放信號分子來發揮多種功能,因此,理解如何有效區分牙齦組織和皮膚組織中間充質干細胞非常重要,這項研究中,研究人員對來自牙齦和皮膚中的間充質干細胞的功能進行了對比,他們發現,GMSCs包含多種蛋白質,包括炎癥抑制因子IL-1RA,其能夠阻斷促炎性細胞因子的釋放,同時IL-1RA還能被用作治療風濕性關節炎的新型療法。
隨后研究人員重點尋找了到底是什么能夠控制IL-1RA和其它細胞因子的釋放,研究者推測這或許是Fas蛋白誘發的,因為該蛋白與機體的免疫調節存在一定關聯;相比皮膚中的間充質干細胞而言,牙齦中的間充質干細胞含有更多的Fas蛋白,而且缺失Fas的小鼠機體中IL-1RA的水平也較低,其所釋放的物質水平也會下降。隨后的分子探針研究結果表明,Fas能夠形成Fap-1和Cav-1的蛋白復合體來誘發小型胞外囊泡的釋放,為了鑒別出這與傷口愈合的關聯,研究人員對傷口組織進行了檢測,他們發現,IL-1RA在傷口周圍的GMSCs中水平會增加,而缺失IL-1RA的小鼠的牙齦愈合速度也會明顯減慢。
相比較而言,當研究人員從GMSCs分離IL-1RA后,并將其注射到創傷部位時,明顯加速了傷口的愈合速度。研究者Kou說道,我們發現,間充質干細胞,尤其是牙齦中的間充質干細胞能夠通過胞外囊泡釋放大量的細胞因子;相關研究發現或許對于糖尿病患者具有明顯的治療意義,研究者指出,相比健康小鼠的GMSCs而言,糖尿病小鼠機體中GMSCs或許并不太會分泌胞外囊泡,而且其GMSCs中也存在較低水平的IL-1RA分泌,引入健康小鼠機體中GMSCs所釋放的胞外囊泡就能夠降低糖尿病小鼠的愈合時間。
10.Glia:神經干細胞再生的機制
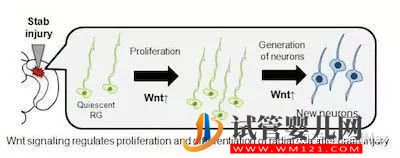
最近,來自Waseda大學的研究者們以成年斑馬魚為對象,通過建立視頂蓋穿刺損傷模型,發現了神經干細胞再生的機制。該發現或許有助于人類中樞神經系統損傷的治療。相關結果發表在最近一期的《GLIA》雜志上。
“與哺乳動物不同,斑馬魚擁有超強的神經元再生功能,因此在大腦受到損傷后能夠快速激發腦組織再生過程。然而,它們的基因與人以及小鼠卻無太大差異”。該研究的作者,來自Waseda大學分子神經學系的教授Toshio Ohshima說道:“此前有研究表明斑馬魚的神經元再生功能能夠應用于小鼠,因此或許人類也擁有相似的潛力”。
在正常情況下,大部分放射狀膠質細胞(RG)都處于靜息狀態,既不會增殖也不會分化。然而,當研究者們給斑馬魚的大腦進行針刺時,免疫熒光檢測結果則表明RG發生分化現象,而且在第三天達到了高峰。到第七天時,受損的斑馬魚大腦與健康斑馬魚大腦之間不再存在明顯差異。進一步的免疫組化實驗結果表明RG能夠分化產生新生神經元,修復大腦視頂蓋的損傷。“通過分子機制方面的研究,我們發現Wnt信號對于調節RG的分化與新生神經元的再生十分關鍵”。





