清華開發(fā)高通量干細(xì)胞微球3D打印機(jī),并揭示干細(xì)胞的再生修復(fù)機(jī)制
據(jù)統(tǒng)計,中國每年因為交通事故等意外傷害導(dǎo)致的死亡人數(shù)約為 10 萬人。其中,大面積組織器官創(chuàng)傷是致死的原因之一。
另外,中國每年約有 2000 萬人遭遇不同程度的燒傷,5% 左右的受傷者需要住院治療,以對受傷組織進(jìn)行修復(fù)。
但是,如何實(shí)現(xiàn)大面積組織器官的有效再生修復(fù),依然是臨床上懸而未決的難題。
作為人體的“原材料”,干細(xì)胞可以產(chǎn)生所有具有特殊功能細(xì)胞。它具備多向分化的潛能,通過定向誘導(dǎo)可以分化成特定的組織或器官,具備良好的再生修復(fù)能力。
當(dāng)前,臨床主要采用干細(xì)胞注射法,來對器官進(jìn)行再生修復(fù)。即通過提取臍帶血內(nèi)的間充質(zhì)干細(xì)胞,制備成干細(xì)胞懸液,然后將懸液注射到受損的器官部位,從而實(shí)現(xiàn)修復(fù)。
然而,這種方法的細(xì)胞留存率較低。注射幾小時后,干細(xì)胞在體內(nèi)的留存率小于 5%[1],干細(xì)胞活性也會迅速下降,難以滿足臨床對于干細(xì)胞數(shù)量和質(zhì)量的要求。
在臨床上,每平方厘米的受損器官需要約 100-300 萬干細(xì)胞,并且干細(xì)胞的干性需要維持在 90% 以上。
此外,間充質(zhì)干細(xì)胞一般來源于臍帶血、脂肪、骨髓等原代組織,存在擴(kuò)增效率低、擴(kuò)增周期長、耗時久等特點(diǎn)。
總體來說,干細(xì)胞在向臨床轉(zhuǎn)化的過程中,依舊面臨著質(zhì)量不可控、留存效率低、價格高昂等問題,極大地阻礙了產(chǎn)業(yè)化的進(jìn)程。
此前,學(xué)界已經(jīng)研發(fā)出若干對策。比如,將干細(xì)胞固定在生物活性支架上,從而提升干細(xì)胞的穩(wěn)定性和留存率。
而對材料進(jìn)行改性設(shè)計、以及修飾功能基團(tuán),能讓生物活性支架充分地模擬人體內(nèi)部的細(xì)胞外基質(zhì)微環(huán)境,為干細(xì)胞生長提供良好的“土壤”。
此外,采用干細(xì)胞微球填充式移植法,可以提升營養(yǎng)物質(zhì)在生物活性支架內(nèi)部的運(yùn)輸效率,為干細(xì)胞生長提供更豐富的營養(yǎng)物質(zhì)。
生物 3D 打印技術(shù),也是人們想到的對策之一。它是一種新型的增材制造技術(shù),可以實(shí)現(xiàn)生物活性因子、細(xì)胞、生物支架在三維空間下的有序排列,提升放生器官的制備效率,并能降低人為因素對于組織器官構(gòu)造的影響,有望解決器官短缺、供體不足、以及大面積創(chuàng)傷后的原位再生修復(fù)等難題。
然而,當(dāng)前的生物 3D 打印技術(shù)對于“生物墨水”的可打印性要求較高。粘度較高的“生物墨水”可打印性更佳,但是生物活性較差;而粘度較低的“生物墨水”的生物活性更優(yōu),也能促進(jìn)細(xì)胞的生長、增殖與分化,但是機(jī)械性能較低,難以實(shí)現(xiàn)對軟組織的生物 3D 打印。

破局:清華團(tuán)隊研發(fā)噴氣式高通量干細(xì)胞微球 3D 打印機(jī)
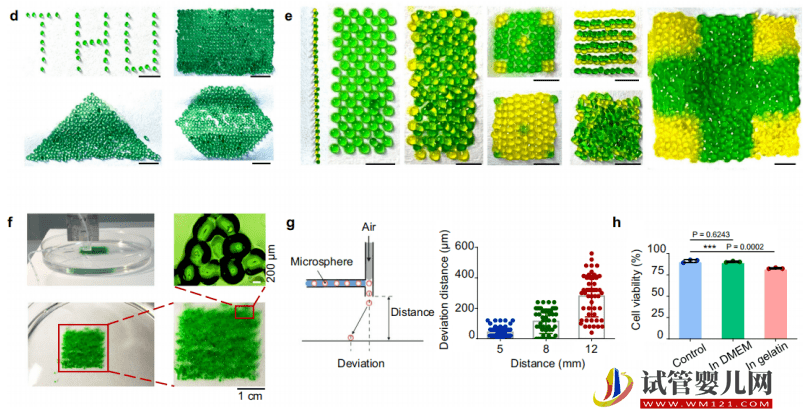
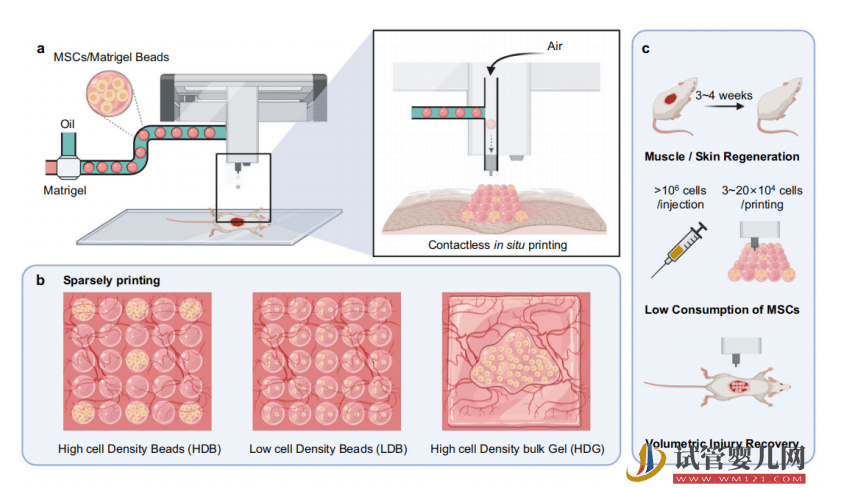
為解決上述問題,清華大學(xué)深圳國際研究生院生物醫(yī)藥與健康工程研究院副教授馬少華和團(tuán)隊,研發(fā)出一款噴氣式高通量干細(xì)胞微球 3D 打印機(jī),并提出高密度干細(xì)胞微球間隙式的移植技術(shù)。
 (來源:Nature Communications)
(來源:Nature Communications)
目前,課題組正準(zhǔn)備與多家醫(yī)院開展合作,打算試點(diǎn)投放這款打印機(jī),以在創(chuàng)傷修復(fù)、組織再生、癌癥藥篩等領(lǐng)域開展臨床試驗。
該成果的優(yōu)勢在于,可以提升干細(xì)胞的利用率和可移植面積,實(shí)現(xiàn)干細(xì)胞微球在受損器官部位的原位 3D 打印,并能成功修復(fù)重度骨骼肌創(chuàng)傷。
同時,還能實(shí)現(xiàn)毛囊的再生,有望用于大面積皮膚創(chuàng)傷和軟器官損傷修復(fù)。而且,全自動化的 3D 打印流程,還能解決當(dāng)前醫(yī)療資源匱乏等問題。
借助這款打印機(jī),在大面積皮膚燒傷的修復(fù)上,研究人員已對缺少 40% 表皮的小鼠皮膚實(shí)現(xiàn)了再生修復(fù)。
 (來源:Nature Communications)
(來源:Nature Communications)
未來,打印機(jī)還能內(nèi)嵌不規(guī)則創(chuàng)面 3D 掃描儀,對不規(guī)則創(chuàng)面進(jìn)行 3D 掃描重建,實(shí)現(xiàn)對于不規(guī)則創(chuàng)面組織的全自動化 3D 打印。
再通過原位生成干細(xì)胞微球、創(chuàng)傷區(qū)域掃描重建、干細(xì)胞微球原位 3D 打印等手段,就能對大面積燒傷病人進(jìn)行再生修復(fù)。
在脂肪填充等美容領(lǐng)域,干細(xì)胞微球間隙式移植技術(shù)可以同時移植干細(xì)胞微球和無細(xì)胞微球,通過干細(xì)胞的高遷移性,能從宏觀層面上實(shí)現(xiàn)干細(xì)胞利用率的最大化。
未來,干細(xì)胞微球和無細(xì)胞微球還有望形成干細(xì)胞微球組,從而用于脂肪填充,鎖住脂肪以避免其流失。同時,干細(xì)胞微球組還具備抗老化的功能,故也能用于美容等領(lǐng)域。
近日,相關(guān)論文以《噴氣式打印使稀疏間充質(zhì)干細(xì)胞圖案化增強(qiáng)骨骼肌和毛囊再生》(Bead-jet printing enabled sparse mesenchymal stem cell patterning augments skeletal muscle and hair follicle regeneration)為題發(fā)表在 Nature Communications 上 [2]。
 圖 | 相關(guān)論文(來源:Nature Communications)
圖 | 相關(guān)論文(來源:Nature Communications)
清華大學(xué)清華-伯克利深圳學(xué)院 2019 級碩士生曹遠(yuǎn)雄是第一作者,馬少華擔(dān)任通訊作者。論文也被期刊編輯選取為 Biotechnology and methods 領(lǐng)域內(nèi)的亮點(diǎn)文章。
 圖 | 從左至右:馬少華、曹遠(yuǎn)雄(來源:資料圖)
圖 | 從左至右:馬少華、曹遠(yuǎn)雄(來源:資料圖)

1 月內(nèi)實(shí)現(xiàn)功能性修復(fù),3 周內(nèi)實(shí)現(xiàn)毛囊再生
據(jù)介紹,該團(tuán)隊長期致力于研究干細(xì)胞與類器官工程,曾發(fā)明一款級聯(lián)微流控微球制備技術(shù),并已用于高通量腫瘤類器官制備、子宮內(nèi)膜與肝臟修復(fù)。
基于此,他們實(shí)現(xiàn)了高通量、自動化的“智能化類器官-個體敏感藥物篩選”技術(shù),將篩藥周期縮短至 1 周內(nèi),通量提高 10 倍以上。另外,其還曾研制一款類器官工程化的原創(chuàng)裝備。
而此次的噴氣式高通量干細(xì)胞微球 3D 打印機(jī),則是級聯(lián)微流控微球制備技術(shù),在再生醫(yī)學(xué)領(lǐng)域的又一探索。(來源:Nature Communications)
 (來源:Nature Communications)
(來源:Nature Communications)
研究中,課題組耗時兩年左右完成從原型機(jī)到實(shí)驗室樣機(jī)的設(shè)計、優(yōu)化、調(diào)試與組裝。其采用模塊化的設(shè)計思路來搭建 3D 打印樣機(jī),只需先完成分模塊的調(diào)試,在所有模塊都完成優(yōu)化后,再組裝起來進(jìn)行整體樣機(jī)的全局匹配與調(diào)試。
打印機(jī)內(nèi)嵌以下模塊:微流控制備模塊、3D 打印模塊、圖像捕捉模塊、以及微球噴射模塊,涵蓋生物、機(jī)械、材料、信息等多學(xué)科。
接下來,要對高密度干細(xì)胞微球間隙式移植技術(shù)進(jìn)行體外測試,包括測試干細(xì)胞的生物活性、安全性、相容性等。
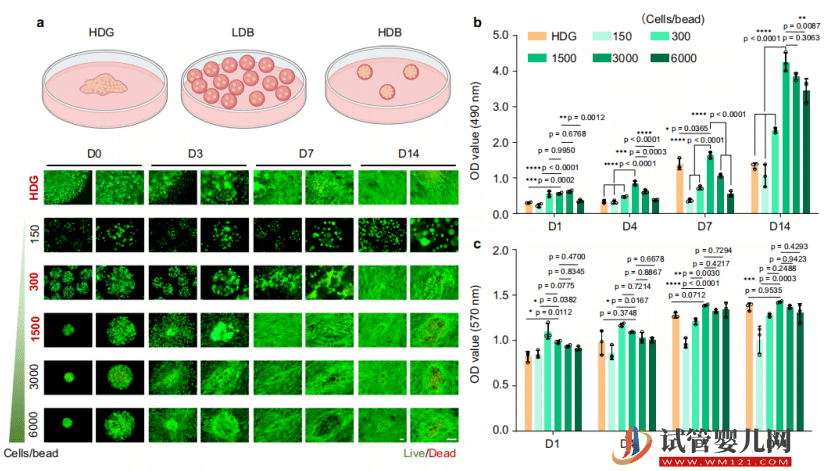
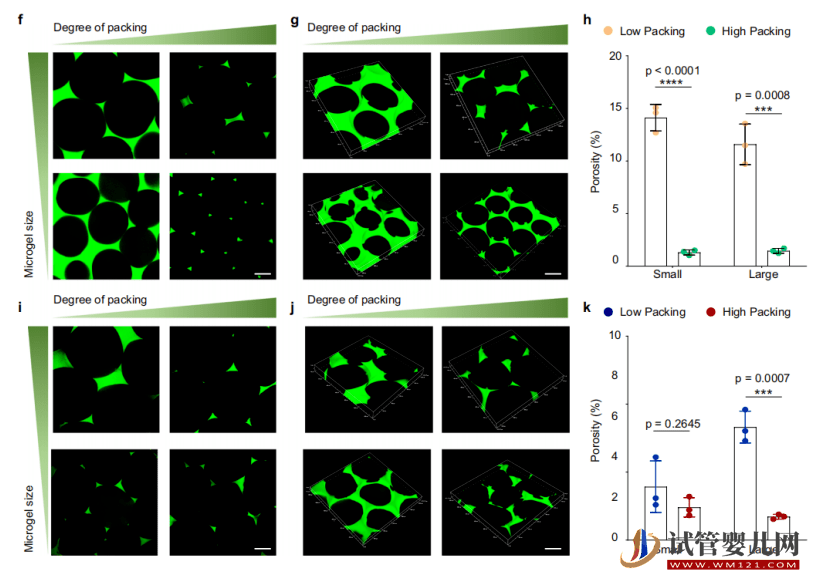
然后,他們還測試了不同細(xì)胞密度的增殖活性,借此篩選出最適合干細(xì)胞生長的細(xì)胞密度。
隨后,針對不同干細(xì)胞密度微球在遷移能力、代謝能力、干性維持能力以及外泌體分泌能力的區(qū)別進(jìn)行比較,借此發(fā)現(xiàn)高密度干細(xì)胞微球可以提升干細(xì)胞生物活性、安全性和相容性。
下一步,則要測試打印機(jī)在重度骨骼肌創(chuàng)傷和毛囊再生修復(fù)上的效果。其中最重要的一項測試在于,對動物體內(nèi)的組織創(chuàng)傷進(jìn)行再生修復(fù)。
為此,他們選取不同的組織,來測試打印機(jī)的修復(fù)性能。對于重度骨骼肌的創(chuàng)傷,在 1 個月內(nèi)實(shí)現(xiàn)了功能性修復(fù);對于小鼠毛囊的損失,則在 3 周內(nèi)實(shí)現(xiàn)了毛囊再生。
實(shí)驗結(jié)果表明,在損失組織的原位打印與再生上,這款打印機(jī)有著優(yōu)良的性能。
但在當(dāng)時,干細(xì)胞的再生修復(fù)機(jī)制仍然是個未解之謎。不過做科研本就需要迎難而上,課題組也決心闡釋干細(xì)胞體內(nèi)的修復(fù)機(jī)制,這也是研究中最難的部分。
通過大量文獻(xiàn)調(diào)研,他們發(fā)現(xiàn)旁分泌作用和分化,是干細(xì)胞發(fā)揮作用的潛在機(jī)理。
為此,該團(tuán)隊采用熒光標(biāo)記法,對干細(xì)胞進(jìn)行熒光標(biāo)記與示蹤,然后將標(biāo)記好的干細(xì)胞植入到體內(nèi),并在不同的時間點(diǎn)提取再生組織、進(jìn)行組織切片與熒光成像,最終確定了干細(xì)胞在體內(nèi)發(fā)揮的作用機(jī)制:即在植入干細(xì)胞的前期,干細(xì)胞會通過增殖與旁分泌發(fā)揮作用;在植入干細(xì)胞的后期,干細(xì)胞會通過分化來發(fā)揮作用。針對這一機(jī)理的解釋,也得到了三位審稿人的認(rèn)可。
 (來源:Nature Communications)
(來源:Nature Communications)

再接再厲:即將研發(fā)人工合成生物活性支架
另據(jù)悉,研究初期該團(tuán)隊原本打算采用快速熱噴法,實(shí)現(xiàn)干細(xì)胞微球的無接觸打印,通過瞬時高溫產(chǎn)生的氣體膨脹,促成干細(xì)胞微球的噴射。
隨后,第一代原型機(jī)的設(shè)計與加工終于完成,其集成微流控模塊、3D 打印模塊、溫控模塊以及噴射裝置。
后來,他們測試了上述原型機(jī)的生物安全性,通過將干細(xì)胞微球快速熱噴射入培養(yǎng)基,并進(jìn)行活死細(xì)胞染色。
測試結(jié)果表明,80% 以上的細(xì)胞因為瞬時加熱而死亡,對于這款原型機(jī)的生物安全性來說,這是一項極大的挑戰(zhàn),也意味著將近一年的努力付諸東流。
但是研究團(tuán)隊并沒有氣餒,再次翻閱大量文獻(xiàn)之后,他們決定改變思路研發(fā)第二代原型機(jī),即通過采用高速流氣體,實(shí)現(xiàn)干細(xì)胞微球的 3D 打印。
鑒于上次的經(jīng)驗教訓(xùn),他們把生物安全性作為首要的考慮因素,在初期就測試了高速流氣體對于干細(xì)胞微球的活死影響。
結(jié)果顯示,高速流氣體有著極高的生物安全性,氣體推動所產(chǎn)生的噴射力,對于干細(xì)胞微球的活死不會有任何影響,這也讓接下來的工作得以延續(xù)。最終完成了本次研究。
未來,他們還打算研發(fā)新型的人工合成生物活性支架,預(yù)計它能充分模擬細(xì)胞外基質(zhì)微環(huán)境,并有望替代當(dāng)前已有的商用基質(zhì)膠產(chǎn)品。





